Uusi Itä-Suomen yliopiston ja Tübingenin yliopiston tutkimus voi selittää, mikä määrittää sen kuinka pitkään yksittäinen lääkeainemolekyyli pysyy sitoutuneena kohteeseensa.
Lääkeainemolekyylin vaikutus alkaa sen sitouduttua kohdeproteiininsa elimistössä. Suurin osa lääkeainemolekyyleistä kuitenkin irtoaa kohteestaan jonkin ajan kuluttua ja poistuu paikalta. Se, kuinka pitkään lääkeainemolekyyli pysyy sitoutuneena kohteeseensa, vaihtelee eri molekyylien välillä ja voi joissain tapauksissa vaikuttaa olennaisesti lääkeaineen tehoon. Sitoutumisajan kestoon vaikuttavien tekijöiden parempi ymmärtäminen mahdollistaakin tarkoituksenmukaisemman lääkeainesuunnittelun.
Nyt julkaistussa tutkimuksessa asiaa tutkittiin kinaasi-inhibiittorimolekyyleillä. Näitä lääkeaineita on käytössä jo kymmenittäin ja suurinta osaa käytetään syövän hoitoon. Tutkijat tunnistivat molekyylitasolla vaikuttavia avaintekijöitä, jotka määrittävät eri kinaasi-inhibiittorimolekyylien pidemmän tai lyhyemmän sitoutumisajan kohteeseensa. Tutkimuksen tulokset julkaistiin Nature Communications -lehdessä.
– Meitä kiinnosti, miksi kahdella rakenteeltaan samankaltaisella kinaasi-inhibiittorimolekyylilä voi olla keskenään erilainen sitoutumisaika kohdeproteiiniinsa, sanoo tutkija Tatu Pantsar Itä-Suomen yliopistosta.
Tutkimuksessa hyödynnettiin professori Stefan Lauferin tutkimusryhmän Tübingenin yliopistossa syntetisoimia uusia kinaasi-inhibiittorimolekyylejä. Ryhmä on jo pitkään kehittänyt p38a MAPK -nimiseen proteiinikinaasiin kohdistuvia kinaasi-inhibiittoreita.
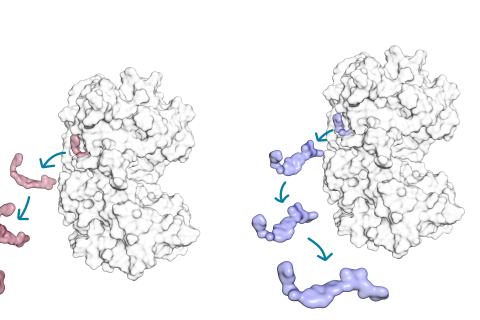
– Tutkimuksessa käytimme kahta kinaasi-inhibiittoria, jotka estävät eristetyn kohdeproteiinin toimintaa kumpikin yhtä tehokkaasti, mutta jotka poikkeavat toisistaan kohdeproteiiniin sitoutumisajan suhteen. Elävissä soluissa testattuna pidemmän sitoutumisajan omaava kinaasi-inhibiittori osoittautui tehokkaammaksi.
Kohdeproteiiniinsa sitoutuneiden kinaasi-inhibiittorien käyttäytymistä tarkasteltiin tutkimuksessa suurteholaskentaa vaativilla tietokonesimulaatioilla, joissa hyödynnettiin suomalaisia supertietokoneita.
Kohdeproteiinin käyttäytyminen riippuu siihen sitoutuneesta molekyylistä.
– Simulaatioiden perusteella lyhyen sitoutumisajan omaavan inhibiittorin kanssa kohdeproteiini on dynaamisempi. Tämä tarkoittaa käytännössä sitä, että proteiini liikkuu enemmän, kun se sitoo lyhyemmän sitoutumisajan inhibiittorimolekyyliä. Kohdeproteiini on taas paljon stabiilimpi eli liikkuu vähemmän, kun siihen on sitoutunut pidemmän sitoutumisajan omaava inhibiittorimolekyyli. Ikään kuin inhibiittorimolekyyli rauhoittaisi sitä, Pantsar kertoo.
Vesimolekyyleillä on iso rooli inhibiittorin vapautumisessa.
– Elimistössä on paljon vettä, ja lukuiset vesimolekyylit ympäröivätkin proteiineja soluissamme. Näillä pienillä vesimolekyyleillä on tärkeä rooli myös tässä prosessissa, koska ne ottavat inhibiittorimolekyylin paikan, kun se poistuu sitoutumistaskustaan proteiinista.
Simulaatioissa pitkän sitoutumisajan omaava inhibiittorimolekyyli on paremmin suojattuna vesimolekyyleiltä ja vesimolekyylien sitoutuminen kohdeproteiinin sitoutumistaskuun vaatii enemmän energiaa. Tämä suurempi energia, joka vaaditaan inhibiittorin syrjäyttämiseksi vesimolekyyleillä, johtaa pidempään kinaasi-inhibiittorin sitoutumisaikaan.
Kohdeproteiinin käyttäytymiseen ja vesimolekyylien rooliin liittyvät havainnot vahvistettiin myös rakenteeltaan täysin erilaisella kinaasi-inhibiittorilla, jolla on erittäin lyhyt sitoutumisaika.
Tutkimuksen tulokset ovat hyödyllisiä alkuvaiheen lääkeainekehitykselle.
– Nyt kun ymmärrämme paremmin atomi- ja molekyylitasolla lääkeaineen sitoutumisen kestoon vaikuttavia tekijöitä, voidaan tätä tietoa hyödyntää jo alkuvaiheen lääkeainesuunnitteluprojekteissa, joissa tavoitellaan pitkää sitoutumisen kestoaikaa. Pelkästään sitoutumisen keston optimointiin ei kuitenkaan kannata keskittyä, koska lääkeaineen suunnittelu on erittäin vaikea ja monisyinen prosessi, jossa täytyy ottaa huomioon lukuisia muitakin tekijöitä, Pantsar toteaa.
Itä-Suomen yliopistossa tutkimus toteutettiin farmasian laitoksella ja osana monitieteisen DrugTech-tutkimusyhteisön toimintaa. Tutkimuksessa hyödynnettiin CSC – Tieteen tietotekniikan keskuksen suurteholaskentaresursseja.
Tutkimusartikkeli:
Pantsar, T., Kaiser, P.D., Kudolo, M. et al. Decisive role of water and protein dynamics in residence time of p38α MAP kinase inhibitors. Nat Commun 13, 569 (2022). https://doi.org/10.1038/s41467-022-28164-4